Hai khám phá mới làm sáng tỏ bí ẩn về cách các tế bào quản lý căng thẳng
Ngày đăng: 05/10/2022 08:16
Hôm nay: 0
Hôm qua: 0
Trong tuần: 0
Tất cả: 0
Ngày đăng: 05/10/2022 08:16
Trong nghiên cứu mới được công bố gần đây trên tạp chí Cell Reports cho thấy, nhóm các nhà khoa học Trường Đại học Massachusetts Amherst đã đi sâu vào tìm hiểu những bí ẩn về cách tế bào chống lại căng thẳng. Khi sử dụng các tế bào vi khuẩn để nghiên cứu, các nhà nghiên cứu phát hiện thấy một loại enzyme sửa chữa tổn thương, được gọi là ClpX, không những có thể đột biến để khắc phục nhiều vấn đề của tế bào mà còn có thể phản ứng với sự thay đổi các mức năng lượng của tế bào để giúp tế bào khỏe mạnh.
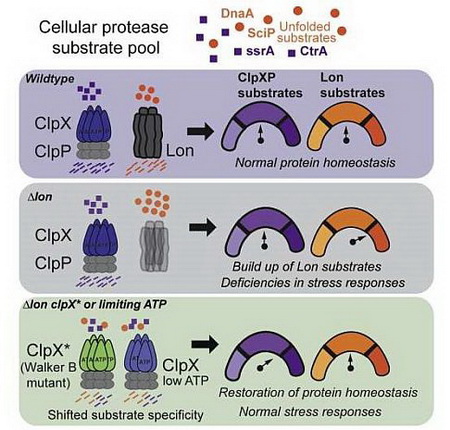 |
Peter Chien, giáo sư sinh hóa và sinh học phân tử tại UMass Amherst và là tác giả chính của bài báo cho biết: "Điều chúng tôi thực sự quan tâm là cách tế bào phản ứng với căng thẳng. Chúng tôi nghiên cứu một loại enzyme, tên gọi là protease, có thể nhắm mục tiêu và phá hủy các protein có hại trong tế bào. Các protease này có thể nhận diện chọn lọc các protein đơn lẻ, cụ thể. Tuy nhiên, câu hỏi là chúng làm điều này bằng cách nào? và làm thế nào chúng có thể lựa chọn giữa protein lành mạnh và protein có hại?".
Để trả lời câu hỏi này, Chien và các đồng tác giả của ông đã tập trung vào hai loại protease cụ thể là Lon và ClpX, mỗi loại được điều chỉnh một cách tinh vi để có thể nhận ra mỗi một loại protein có hại khác nhau. Từ lâu, người ta đã nghĩ rằng Lon và ClpX hoạt động giống như những chiếc chìa khóa: Mỗi chiếc chỉ có thể mở một ổ khóa cụ thể và không thể mở ổ khóa khác, và nếu thiếu đi một trong hai tế bào này thì các tác dụng phụ nghiêm trọng sẽ xảy ra.
Nhưng, sau một loạt các thí nghiệm liên quan đến việc xóa Lon khỏi các khuẩn lạc (cụm vi khuẩn) của tế bào vi khuẩn, nhóm của Chien bắt đầu nhận thấy một điều kỳ lạ: Một số khuẩn lạc vẫn sống sót.
Quan sát này dẫn đến khám phá đầu tiên của họ: ClpX có thể biến đổi để thực hiện chức năng giống như Lon, mặc dù nó mất đi một số khả năng ClpX của chính nó.
Để truy tìm chính xác cách thức đột biến ClpX cho phép protease mở rộng chức năng của nó, nhóm nghiên cứu đã phát hiện thấy rằng: ClpX không đột biến, hoang dã, cũng có thể thực hiện một số nhiệm vụ của Lon, trong những điều kiện thích hợp.
Điều này chỉ ra rằng ClpX rất nhạy cảm với ATP, một hợp chất hữu cơ, là nguồn năng lượng cho tất cả các tế bào sống. Khi ATP ở mức bình thường, ClpX tập trung vào nhiệm vụ của chính nó, nhưng ở ngưỡng cụ thể, như thấp hơn, nó đột ngột bắt đầu “dọn dẹp” bất chấp Lon.
"Đây là một bước đột phá thực sự trong sự hiểu biết cơ bản về cách thức hoạt động của tế bào. Nó thay đổi các quy tắc rằng không chỉ năng lượng tế bào kiểm soát tốc độ hoạt động của tế bào mà còn cả cách hoạt động của nó", Chien cho biết.
Theo Vista.gov.vn