FDA phê duyệt thuốc điều trị Alzheimer thứ hai
Ngày đăng: 16/01/2023 15:07
Hôm nay: 0
Hôm qua: 0
Trong tuần: 0
Tất cả: 0
Ngày đăng: 16/01/2023 15:07
Một số nhà nghiên cứu hoan nghênh quyết định của FDA, nhưng một số khác lo ngại về độ an toàn của thuốc sau các trường hợp tử vong trong thử nghiệm, và cho rằng FDA một lần nữa đã quá vội vàng, giống như khi phê duyệt thuốc điều trị Alzheimer đầu tiên vào năm 2021.
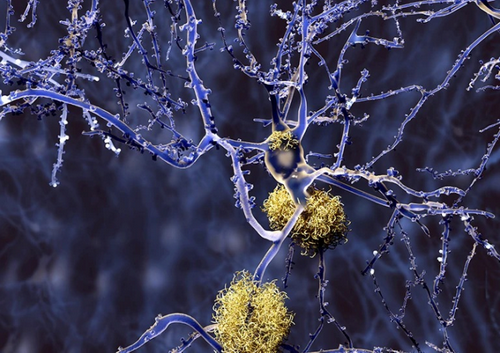 |
| Các khối protein được gọi là mảng amyloid (màu vàng) nằm giữa các tế bào thần kinh (màu xanh tím) là một dấu hiệu đặc trưng của bệnh Alzheimer. |
Tác dụng của lecanemab
Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) vừa phê duyệt lecanemab, thuốc được cho là có tác dụng làm chậm quá trình suy giảm nhận thức, dùng trong điều trị Alzheimer.
Lecanemab, sẽ được bán dưới tên Leqembi, là phương pháp điều trị bệnh Alzheimer đầu tiên cho thấy khả năng làm chậm quá trình suy giảm nhận thức trong một thử nghiệm lâm sàng.
Thuốc được sản xuất bởi 2 công ty dược phẩm sinh học: Eisai ở Tokyo, Nhật Bản và Biogen ở Cambridge, Massachusetts, Mỹ. Thuốc là kháng thể đơn dòng, sử dụng theo đường truyền tĩnh mạch. Sau khi đi vào não, thuốc sẽ loại bỏ các mảng amyloid được cho là nguyên nhân gây suy giảm nhận thức và chứng mất trí ở bệnh Alzheimer.
Thuốc đã được phê duyệt theo quy trình "tăng tốc" của FDA, dành cho các thuốc điều trị các bệnh hiện có ít phương pháp điều trị, và không yêu cầu dữ liệu thử nghiệm lâm sàng giai đoạn III.
FDA đưa ra quyết định dựa trên cơ sở dữ liệu giai đoạn II, cho thấy lecanemab làm giảm các mảng bám amyloid trong não của 856 bệnh nhân, nhưng không đánh giá liệu tác động này có ảnh hưởng đến khả năng nhận thức hay không. Đây là cơ chế tương tự với aducanumab, một kháng thể cũng do Biogen và Eisai phát triển, đã được FDA phê duyệt vào năm 2021.
Dù vậy Biogen và Eisai vẫn tiến hành thử nghiệm giai đoạn III với lecanemab. Thử nghiệm được thực hiện trên khoảng 1.800 người bệnh Alzheimer giai đoạn đầu, cho thấy thuốc làm chậm quá trình suy giảm nhận thức 27% sau 18 tháng điều trị. Quyết định chấp thuận mới đây của FDA không tính đến thử nghiệm này.
Vấn đề gây tranh cãi về hiệu quả là không rõ hiệu ứng 27% của lecanemab có tác động gì đối với cuộc sống của những người bệnh Alzheimer, hoặc có kéo dài sau 18 tháng hay không.
Theo Eric Reiman, giám đốc điều hành của Viện Banner Alzheimer ở Arizona, Mỹ, tác động thực tế có thể là “người bệnh có thêm 6 tháng nhận ra khuôn mặt người thân hoặc thực hiện một hoạt động yêu thích”. Nhưng đó chỉ là dự đoán, và để kết lận chính xác đòi hỏi phải nghiên cứu thêm về tác động của thuốc trong tương lai, Reiman nói.
Trong khi chưa có các kết quả này, FDA cho biết, lecanemab chỉ được sử dụng cho những người bị suy giảm nhận thức nhẹ, tương tự như nhóm bệnh nhân tham gia các thử nghiệm lâm sàng.
Những lo ngại trước quyết định của FDA
Trong khi đó, giới chuyên môn không chắc rằng lợi ích của thuốc xứng đáng với rủi ro. Theo họ, bệnh nhân là những người bị suy giảm nhận thức nhẹ, vẫn đang có cuộc sống bình thường và bị đặt vào rủi ro cả về sức khỏe và tài chính - tại Mỹ, một năm dùng lecanemab sẽ có giá 26.500 USD.
Trong những tháng gần đây, Science và STAT News đã báo cáo 3 người tham gia thử nghiệm lecanemab giai đoạn III đã tử vong trong giai đoạn mở rộng của thử nghiệm. (Trong giai đoạn mở rộng, bệnh nhân dùng giả dược có thể được dùng thuốc.) 3 người này chết vì các biến chứng liên quan đến chảy máu não và co giật.
Các nhà nghiên cứu cho rằng bệnh nhân có thể đã chết vì một loạt các tình trạng được gọi chung là bất thường liên quan đến amyloid (ARIA). Họ nghi ngờ kháng thể làm suy yếu các mạch máu não trong quá trình tấn công các mảng bám amyloid. Tất cả các bệnh nhân đều đang dùng thuốc chống đông máu vào thời điểm tử vong, điều này có thể khiến tình trạng chảy máu trở nên tồi tệ hơn.
Eisai tuyên bố rằng việc kết luận dựa trên các trường hợp riêng lẻ là không khách quan, và họ đã báo cáo các trường hợp tử vong cho FDA. FDA chấp thuận lecanemab nhưng yêu cầu các công ty đưa ra cảnh báo đi kèm thuốc về ARIA.
Tranh cãi xung quanh aducanumab, được FDA chấp thuận theo quy trình "tăng tốc" vào ngày 7/6/2021, cũng gây thêm lo ngại đối với lecanemab. Nhiều nhà nghiên cứu cho rằng aducanumab, còn có tên thương mại là Aduhelm, không cho thấy tác dụng rõ ràng. Thậm chí hội đồng cố vấn khoa học của FDA đã khuyến nghị không chấp thuận aducanumab, với kết quả bỏ phiếu 8-1 nghiêng về không chấp thuận. 3 thành viên hội đồng đã từ chức ngay lập tức sau khi FDA quyết định phê duyệt aducanumab. Cơ quan này đã không tổ chức một cuộc họp tư vấn công khai cho lecanemab trước khi phê duyệt thuốc.
Kể từ khi aducanumab được chấp thuận, Biogen và FDA đều bị các cơ quan giám sát theo dõi sát sao hơn. Một cuộc điều tra của Quốc hội Mỹ được công bố vào tháng 12/2022 cho thấy FDA đã vi phạm các quy tắc của chính mình, với việc hướng dẫn Biogen trong quy trình xin cấp phép cho aducanumab. Báo cáo nói rằng quy trình chấp thuận thuốc “đầy rẫy những điểm bất thường” và "đặt ra những lo ngại nghiêm trọng về quy trình lỏng lẻo của FDA và về sự coi thường hiệu quả thuốc của Biogen”, nhưng Quốc hội Mỹ không nêu ra bất kỳ hình phạt nào đối với FDA hoặc các công ty.
Trung tâm Dịch vụ y tế của Mỹ (CMS) đã từ chối chi trả cho aducanumab trong các chương trình bảo hiểm liên bang, trừ khi bệnh nhân đăng ký tham gia thử nghiệm lâm sàng, khiến hầu hết bệnh nhân phải trả hơn 28.000 USD cho một năm điều trị nếu có nhu cầu. CMS và một số phòng khám Alzheimer đã từ chối kê đơn aducanumab, bởi hiệu quả đáng ngờ.
Bất chấp những tranh cãi, Reiman hy vọng rằng thành công của lecanemab sẽ mở ra cơ hội cho sự chấp thuận thuốc điều trị Alzheimer nhanh hơn trong tương lai. Reiman hiện hợp tác với công ty dược phẩm Eli Lilly để thử nghiệm kháng thể đơn dòng donanemab. Dự kiến FDA sẽ quyết định có phê duyệt donanemab hay không trong vài tuần tới.
Khoahocphattrien