FDA phê duyệt thuốc điều trị Alzheimer mới
Ngày đăng: 10/06/2021 09:04
Hôm nay: 0
Hôm qua: 0
Trong tuần: 0
Tất cả: 0
Ngày đăng: 10/06/2021 09:04
Kháng thể aducanumab mới đây đã trở thành loại thuốc điều trị bệnh Alzheimer đầu tiên được chấp thuận tại Mỹ kể từ năm 2003.
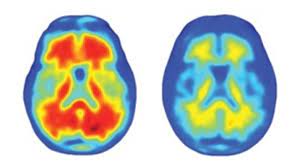 |
| Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ phê duyệt aducanumab dựa trên bằng chứng cho thấy nó làm giảm sự tích tụ amyloid beta (bên trái) trong não của những người bị bệnh Alzheimer. |
Trong một quyết định gây tranh cãi khiến một số chuyên gia bị sốc, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã bỏ qua khuyến nghị của một nhóm cố vấn để kết luận rằng loại thuốc được phát triển bởi Biogen xứng đáng được đưa ra thị trường. FDA quyết định chấp thuận thuốc bất chấp thực tế có ít bằng chứng về hiệu quả của aducanumab trong việc làm chậm sự suy giảm nhận thức ở bệnh nhân Alzheimer.
FDA cho biết đã chấp thuận aducanumab, được bán trên thị trường với tên Aduhelm, dựa trên bằng chứng mạnh mẽ rằng nó loại bỏ dạng độc hại của protein beta amyloid - chất tích tụ trong não của những người mắc bệnh Alzheimer và được cho là gây tổn thương tế bào thần kinh. Việc giảm chất độc hại này được dự đoán là có khả năng đem lại những lợi ích quan trọng đối với bệnh nhân, theo FDA.
Nhưng một số loại thuốc nhắm vào amyloid trong những năm gần đây đã không cho thấy lợi ích trong các thử nghiệm lâm sàng lớn. Quyết định của FDA, dù được một số nhà nghiên cứu và các nhóm hoạt động hoan nghênh, đã vấp phải sự phản đối của nhiều người.
Joseph Ross, chuyên gia về chính sách quản lý của FDA tại Trường Y Yale, cho biết chưa từng có việc FDA chuyển từ quy trình phê duyệt tiêu chuẩn sang một "lộ trình phê duyệt nhanh", không yêu cầu bằng chứng lâm sàng mà dựa vào bằng chứng thay thế, beta amyloid, chưa chắc đã phản ảnh tác dụng thực tế.
FDA sẽ yêu cầu Biogen hoàn thành thử nghiệm lâm sàng sau phê duyệt để xác minh lợi ích của thuốc. Hai thử nghiệm lớn trước đây của công ty, bao gồm hơn 3.000 người ở 20 quốc gia, cho ra kết quả không rõ ràng. Năm 2019, Biogen và công ty dược phẩm Nhật Bản Eisai, đồng phát triển aducanumab, thông báo sẽ tạm dừng cả hai thử nghiệm sau khi phân tích tạm thời dữ liệu cho thấy loại thuốc này không mang lại lợi ích gì cho bệnh nhân. Nhưng vào cuối năm đó, họ đã đảo ngược kết luận, đưa ra một phân tích khác dựa trên dữ liệu mới. Phân tích đó cho thấy sự suy giảm nhận thức giảm 22% ở nhóm dùng hai liều aducanumab cao, so với nhóm dùng giả dược.
Việc đảo ngược kết luận như vậy khiến nhiều nhà nghiên cứu bối rối và hoài nghi. Một số người thúc giục FDA yêu cầu Biogen thực hiện một thử nghiệm lớn khác trước khi thuốc được phê duyệt. Họ đồng thời cho rằng Bioge đã không chứng minh được lợi ích tiềm năng vượt trội của thuốc so với tác dụng phụ mà nó có khả năng gây ra, bao gồm sưng não. Tại một cuộc họp của ủy ban cố vấn độc lập do FDA triệu tập vào tháng 11/2020, đa số các chuyên gia bỏ phiếu cho rằng dữ liệu từ một thử nghiệm tích cực (tức thử nghiệm đạt kết quả có ý nghĩa thống kê) không phải là “bằng chứng quan trọng về hiệu quả”.
FDA hiếm khi đi ngược lại các khuyến nghị của ủy ban cố vấn. Trong một phân tích về các phán quyết của FDA từ năm 2008 đến năm 2015, Ross và các đồng nghiệp nhận thấy, 89% các quyết định phê duyệt thuốc phù hợp với các khuyến nghị của ủy ban cố vấn. Trong một lá thư gửi tới ủy ban cố vấn, FDA giải thích việc đi ngược lại khuyến nghị của ủy ban và chuyển sang một tiêu chuẩn phê duyệt khác với lý do “nhu cầu y tế to lớn chưa được đáp ứng” đối với các phương pháp điều trị bệnh Alzheimer.
Một số nhà nghiên cứu và các nhóm vận động đã cổ vũ quyết định này của FDA, đồng thời thừa nhận rằng Aduhelm không phải là thuốc "chữa" được Alzheimer. “Lịch sử đã cho chúng ta thấy rằng việc phê duyệt loại thuốc đầu tiên cho một căn bệnh sẽ tạo thêm động lực phát triển các loại thuốc khác”, Maria Carrillo, giám đốc khoa học tại Hiệp hội bệnh Alzheimer phi lợi nhuận, cho biết trong một tuyên bố.
Chống lại sự suy giảm nhận thức bằng cách phá vỡ các mảng amyloid từ lâu đã là chiến lược hàng đầu trong việc phát triển thuốc điều trị Alzheimer. Và quyết định của FDA “chắc chắn sẽ là một lý do để tiếp tục dòng nghiên cứu này”, Richard Hodes, giám đốc Viện Quốc gia về Lão hóa Hoa Kỳ, nói. Tuy nhiên, ông lưu ý, các chiến lược điều trị bệnh Alzheimer cũng đang nhanh chóng đa dạng hóa ra ngoài amyloid.
Theo Khoahocphattrien